VI.2. Vörösvértestek, valamint az oxigén és széndioxidszállítás mechanizmusa
átmérő: 7-8 μm
keletkezés: vörös csontvelőben erythropoietin hatására (vese termeli, trigger: hypoxia)
A vörösvérsejtek képzésének legfőbb ingere a szöveti hypoxia, melynek hatására a vese juxtaglomuláris apparátusában megindul az erythropoetin szekréciója, mely hatással van a csontvelőre, ahol emiatt a képződő sejtek vörösvértest(erytrocyta) irányba differenciálódnak.
élettartam: kb 120 nap
A vörösvérsejtek felépítéséhez szükséges anyagok:
- B12 - vitamin (cianokobalamin)
-
Apoeritein
-
Folsav
szerepe a DNS szintézisében van. -
C vitamin (aszkorbinsav)
hiányában a folsav nem alakul át biológiailag aktív formává. -
B6 vitamin
a hem szintézis egyik koenzimje, hiányában porfirin képződési zavar alakul ki. -
Réz, nikkel
a hemoglobin szintézisében szerepet játszó enzimek alkotója, bevitel: 2 mg/nap. -
Kobalt
vas felszívódásához szükséges -
Vas (Fe2+)
A hemoglobin nélkülözhetetlen eleme
A hemoglobin szintézise a mitochondriumban kezdődik, glicinből és 2 α - ketoglutársavból porfobilinogén keletkezik. A 4 pirolgyűrű enzim hatására kondenzálódik, s a kialakuló tetrapirolgyűrű adja a porfirinvázat. A képződő porfirin kémiai kötést létesít a Fe2+ ionnal és hemmé alakul. E vegyület O2 kötő képességét a globinmolekula beépülésével nyeri el. A globin szintézisét a hem indukálja, alapelemei a májban szintetizálódnak.
A magzati (foetalis) életben embrionális hemoglobin szintetizálódik (HbE → 2α és 2ε polipeptidlánc), majd ez felváltja a foetalis hemoglobin (HbF → 2α és 2γ polipeptidlánc), és ez felnőttkorban átalakul HbA-é (2α és 2β) és HbA2-vé (2α és δ) alakul. A hemoglobin a csontvelői macroblastok endoplazmás reticulumának riboszómáiban nyeri el végső struktúráját, ahol 4 hem és 1 globin kapcsolódik. A hemoglobin O2 megkötő képessége a hem Fe2+ ionjának elektronkészletétől függ, mely kötés laza és reverzibilis. A hemoglobin az O2 megkötése után oxihemoglobinná alakul (HbO2).
Az érett vörösvérsejt élettartama kb. 120 nap. Az elöregedett sejteket a lép kiszűri, felismerve azok megváltozott alakját és membránstruktúráját. Ezek a lépben szétesnek, kiszabadul belőlük a hemoglobin.A hemről leszakadt Fe2+ ismét visszatér a csontvelőbe, és újonnan felhasználódik a hemszintéziséhez. A porfirinváz is átalakul, bilirubin lesz belőle. A hemoglobin lebontásából indirekt bilirubin keletkezik naponta, mely a vérkeringéssel jut el a májsejtekbe. Ez a szabad bilirubin a májsejtekben glukagonsavval konjugálódik. Ez a direkt bilirubin a májban képződő epe fontos alkotórésze. A májsejtekből az epe az epekapillárisokba kerül és a duodénumba ömlik. Mivel a direkt bilirubin vízoldékony, kóros körülmények között a véráramba juthat, ott bizonyos szintet elérve a vesén át kiválasztódva kiválasztódik a vizeletben. A duodénumba jutott bilirubin kiürül a szervezetből, vagy felszívódik és visszakerül a májba (enterohepatikus recirkuláció).
A magzati vörösvérsejtek élettartama rövidebb, kb. 80 nap. A magzat vörösvérsejt száma nagyobb, s a születés után a felesleg szétesik, emiatt alakulhat ki a születés után 4-5 nappal fiziológiás sárgaság (icterus).
Az anaemia (vérszegénység)
Hiányanaemiák
- vashiányos anaemia
Hiányzik a hemoglobin szintéziséhez szükséges vas. Oka lehet: elégtelen mennyiségű vas bevitele vagy a vas felszívódásának zavara. Ilyenkor a képződő erythrocyták száma csökken és összességében kevesebb O2 szállítására képesek.
- anaemia pernicosa
B12 vitamin vagy folsavhiány esetén, esetleg a B12 vitamin felszívódását segítő a poeritein elégtelen képződése esetén jön létre.
- hypercrom megaloblastos anaemia
A vörösvérsejtek DNS anyagcsere zavarához vezet a betegség. A csontvelőben atípusos megaloblastok képődnek. B12 vitamin parenterális adására a vörösvérsejtképzés üteme felgyorsul.
- aplasztikus anaemia
Ionizáló sugárzás, mérgező kémiai anyagok, gyógyszerek, daganatok hatására a csontvelői őssejtek differenciálódása károsodik. Csökken az erythrocyták, a granulocyták, és a thrombocyták száma a vérben.
Vérvesztéses anaemiák
- Hemolitikus anaemiák
Leggyakoribb okai:
Enzimdefektus
Haemoglobinopathiák
Fizikai vagy kémiai ártalmakra, és kórokozók (malária, giardiasis) hatására is fokozódhat a hemolízis.
Helytelen transzfúzió
- Methemoglobinaemia
A normális hemoglobinban a vas kétértékű, mely oxidálószerek hatására ferrivassá alakulhat. A ferrivasat tartalmazó, stabil ionos kötéssel kapcsolja magához az oxigént, s ezt leadni nem tudja, emiatt hypoxia léphet fel. Kevés methemoglobin élettani körülmények között is képződik a vörösvérsejtekben, ezt azonban a felnőttek vérében lévő methemoglobin-reduktáz ismét hemoglobinná alakítja. Újszülöttekben ilyen enzim nincs, ezért a nitrit-nitrát tartalmú víz vagy étel súlyos hypoxiás szövetkárosodáshoz vezethet.
A kisvérköri kapillárisok vérébe bekerült oxigén kb. 2 %-a a vérplazmában fizikailag oldva szállítódik, 98 %-a pedig a vörösvérsejtekben található hemoglobinhoz kötődik. A hemoglobin tetramer szerkezetű kromoproteid, 4 hem alegysége 4 molekula oxigén reverzibilis megkötésére képes. A hemoglobinban található vashoz nemcsak oxigén, hanem szénmonoxid is kapcsolódhat. A CO-hemoglobin nem képes O2-szállításra, tehát a CO-mérgezés életveszélyes állapotot teremt. A vázizomban, egy hemoglobin alegységhez hasonló molekula, mioglobin szerepel oxigénraktárként.
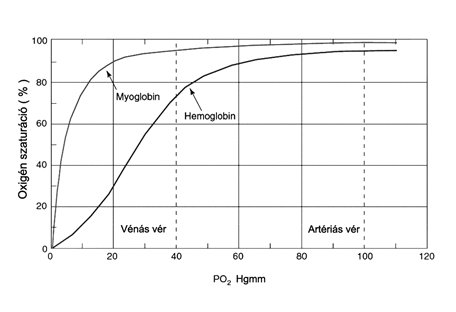
Az oxigénkötő fehérjéket telítési görbéjükkel jellemezhetjük, amely azt mutatja, hány százalékuk köt O2-t különböző parciális O2 nyomásoknál. Alapvető különbség mutatkozik a két molekula oxigéntelítési görbéjében. A myoglobin oxigénkötési görbéje hiperbola, a hemoglobin szigmoid, ami az elegységek közöti kooperativitásra utal, meg arra, hogy a hemoglobin alloszterikus protein. A myoglobin alkalmatlan lenne oxigénszállításra, mivel a szövetekben fennáló viszonyok között nem adná le az oxigént (17. ábra).
17. ábra a hemoglobin és a mioglobin oxigéntelítési görbéje
A szállított széndioxid mennyiségének kb. 10 %-a fizikailag oldott állapotban van a vérplazmában, 20 %-a a hemoglobin globin részével lép kémiai kötésbe, 70 %-a pedig bikarbonát formájában szállítódik. A bikarbonát a vörösvérsejtekben képződik a szénsav disszociációja révén. A szénsavképződést a szénsavanhidráz enzim katalizálja. A vörösvértestben képződött bikarbonát kloridra cserélődve kilép a vérplazmába. Az intra- és extracelluláris ioneltolódást leírója után Hamburger shiftnek nevezik.